L’histoire de la médecine : des origines à la modernité
La médecine est née bien avant d’être une science. D’abord empirique, faite de gestes instinctifs et de plantes médicinales, elle a pris forme dans les grandes civilisations antiques avec les papyrus égyptiens, l’Ayurveda indien ou la médecine traditionnelle chinoise. Mais c’est en Grèce antique qu’elle s’est réellement transformée en discipline rationnelle grâce à Hippocrate, puis à Galien qui, à Rome, a systématisé l’anatomie et la physiologie. Après la chute de l’Empire romain, le savoir fut préservé par les moines et enrichi par les savants arabes comme Avicenne. La Renaissance marqua une rupture avec Vésale et Paré, et le XIXe siècle fit entrer la médecine dans son ère moderne grâce à Pasteur, Koch, l’anesthésie et l’asepsie. Enfin, le XXe siècle ouvrit les portes de la chirurgie cardiaque, des antibiotiques, de l’imagerie médicale et de la chirurgie plastique, préparant le terrain pour la médecine globale d’aujourd’hui.
Les “gueules cassées” et la naissance de la chirurgie reconstructrice
La Première Guerre mondiale fut un tournant décisif : les “gueules cassées”, soldats défigurés par les éclats d’obus, imposèrent aux médecins un défi inédit. Il ne s’agissait plus seulement de sauver la vie, mais de restaurer un visage, une identité, une dignité. Les premiers grands progrès en chirurgie maxillo-faciale et en greffes de peau virent le jour, donnant naissance à la chirurgie reconstructrice. De cette urgence humaine est née une nouvelle mission pour la médecine : réparer le corps autant que l’âme.
De la reconstruction à la chirurgie esthétique
Les techniques mises au point pour les blessés de guerre se sont progressivement ouvertes à d’autres indications : corriger une malformation, améliorer une silhouette, répondre à un désir personnel de transformation. La chirurgie esthétique s’est ainsi développée au XXe siècle comme une extension naturelle de la chirurgie reconstructrice. Aujourd’hui, elle ne se limite plus à réparer, elle accompagne chaque patient dans sa quête d’harmonie, de confiance et de mieux-être.
Très bien 🙌
Je vais développer beaucoup plus la partie consacrée aux opérations de chirurgie esthétique et aux actes de médecine esthétique, en détaillant les objectifs, les techniques, le déroulement, les suites et les bénéfices. Cela donnera un contenu de homepage médicale globale très riche et structuré, qui rassure et informe le lecteur.
Les grandes opérations de chirurgie esthétique
🔹 Augmentation mammaire
L’augmentation mammaire est sans doute l’une des interventions les plus connues et les plus pratiquées en chirurgie esthétique. Elle s’adresse aux femmes qui souhaitent augmenter le volume de leur poitrine, corriger une asymétrie ou retrouver un galbe perdu après une grossesse ou une perte de poids. L’intervention repose sur la mise en place de prothèses mammaires de dernière génération, fabriquées à partir de gel de silicone cohésif, garantissant à la fois sécurité et rendu naturel.
Les techniques opératoires ont beaucoup évolué : l’incision peut être réalisée sous le sein (voie sous-mammaire), autour de l’aréole (voie péri-aréolaire) ou sous l’aisselle (voie axillaire). Le positionnement des implants peut être sous-glandulaire, sous-musculaire ou en dual-plane, selon la morphologie et le résultat souhaité.
Le déroulement : l’opération dure en moyenne 1h à 1h30 sous anesthésie générale. L’hospitalisation est généralement courte (ambulatoire ou 24h).
Les suites : quelques douleurs musculaires, contrôlées par des antalgiques, un œdème et parfois des ecchymoses les premiers jours. Le port d’un soutien-gorge de contention est recommandé durant 4 à 6 semaines.
Les bénéfices : une poitrine plus harmonieuse, un galbe durable, une silhouette équilibrée et un regain de confiance. Les prothèses actuelles offrent une sécurité renforcée, avec un suivi à long terme.
🔹 Abdominoplastie
L’abdominoplastie, ou plastie abdominale, est une opération qui vise à corriger l’excès de peau, le relâchement cutané et parfois musculaire de la zone abdominale. Elle est particulièrement indiquée après une grossesse, une perte de poids importante ou lorsque le ventre présente une distension irréversible malgré l’exercice physique et l’alimentation équilibrée.
La technique consiste à retirer l’excédent cutané situé entre le nombril et le pubis, à retendre la peau vers le bas et, si nécessaire, à réparer les muscles abdominaux en cas de diastasis (écartement des grands droits). Le nombril est repositionné de manière naturelle.
Le déroulement : l’intervention dure 2 à 3 heures sous anesthésie générale. Une hospitalisation de 1 à 2 jours est fréquente.
Les suites : œdème et gêne modérée au début, port d’une gaine de compression pendant 4 à 6 semaines, reprise progressive des activités. Les cicatrices, situées au niveau du pubis, sont dissimulables sous les sous-vêtements.
Les bénéfices : un ventre plat, une silhouette redessinée, un confort retrouvé dans les vêtements et parfois une amélioration de la posture grâce à la remise en tension de la sangle abdominale.
🔹 Chirurgie du visage
Le visage est au centre de l’expression et de l’identité, et de nombreuses interventions permettent d’en corriger les signes du temps ou d’harmoniser les traits.
- Le lifting : il traite le relâchement cutané du visage et du cou en retendant la peau et les tissus profonds, pour un rajeunissement global et naturel. Les techniques modernes privilégient des liftings mini-invasifs, ciblés et personnalisés.
- La blépharoplastie (chirurgie des paupières) : elle enlève l’excès de peau et les poches graisseuses au niveau des paupières supérieures et inférieures, pour ouvrir le regard et donner un air reposé.
- La rhinoplastie : elle corrige les défauts esthétiques ou fonctionnels du nez, en améliorant à la fois l’harmonie du visage et la respiration.
Les bénéfices de ces interventions : un rajeunissement subtil, une harmonie retrouvée, sans altérer les expressions naturelles.
🔹 Chirurgie de la silhouette
Au-delà de l’abdominoplastie, d’autres interventions permettent de remodeler le corps :
- Liposuccion : elle élimine de façon définitive les amas graisseux résistants aux régimes et au sport (hanches, cuisses, ventre, bras).
- Lifting des bras et des cuisses : corrige le relâchement cutané après une perte de poids.
- Lipofilling : consiste à réinjecter sa propre graisse (prélevée par liposuccion) pour remodeler certaines zones comme la poitrine ou les fesses, avec un rendu naturel.
La médecine esthétique : des solutions sans chirurgie
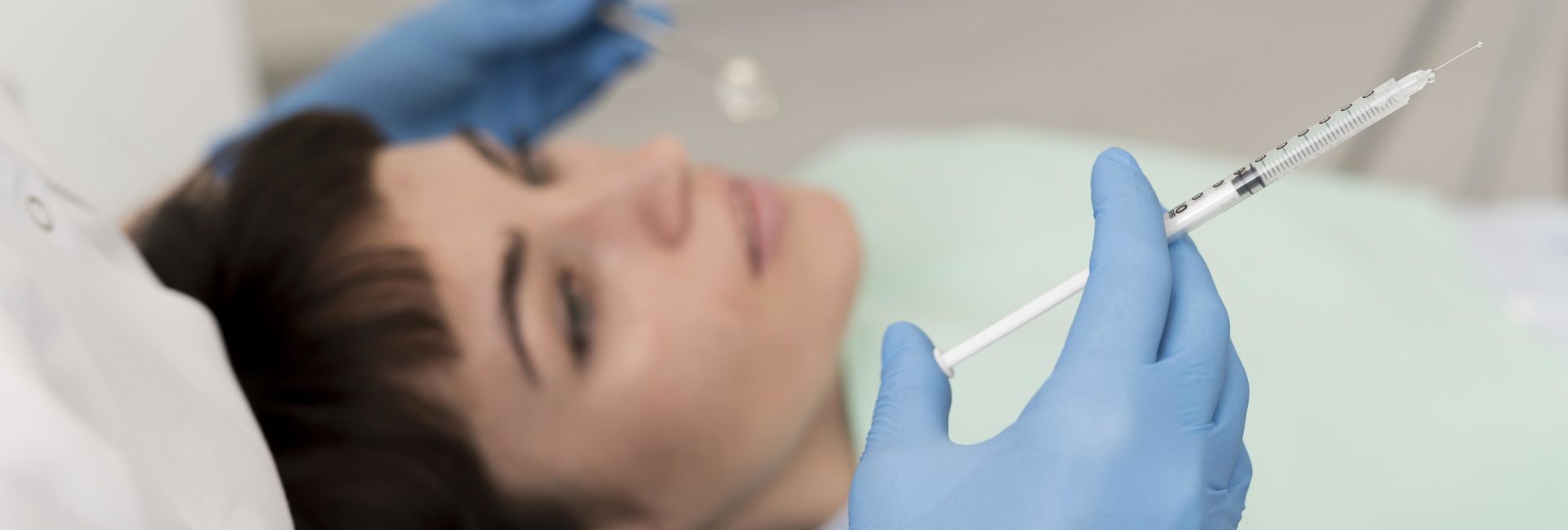
🔹 Injections de fillers
Les fillers, principalement à base d’acide hyaluronique, sont utilisés pour combler les rides, restaurer les volumes, repulper les lèvres, redessiner l’ovale du visage ou rajeunir les mains.
Le geste est rapide et peu douloureux, grâce à des aiguilles fines ou des micro-canules. Les résultats sont immédiats et naturels, et durent de 9 à 18 mois selon le produit utilisé.
Les bénéfices : un visage plus jeune, plus reposé, sans chirurgie ni éviction sociale.
🔹 Toxine botulique (Botox®)
Elle agit en relaxant les muscles responsables des rides d’expression (front, rides du lion, pattes d’oie). Les injections lissent les traits tout en conservant la mobilité et les expressions naturelles lorsqu’elles sont bien réalisées.
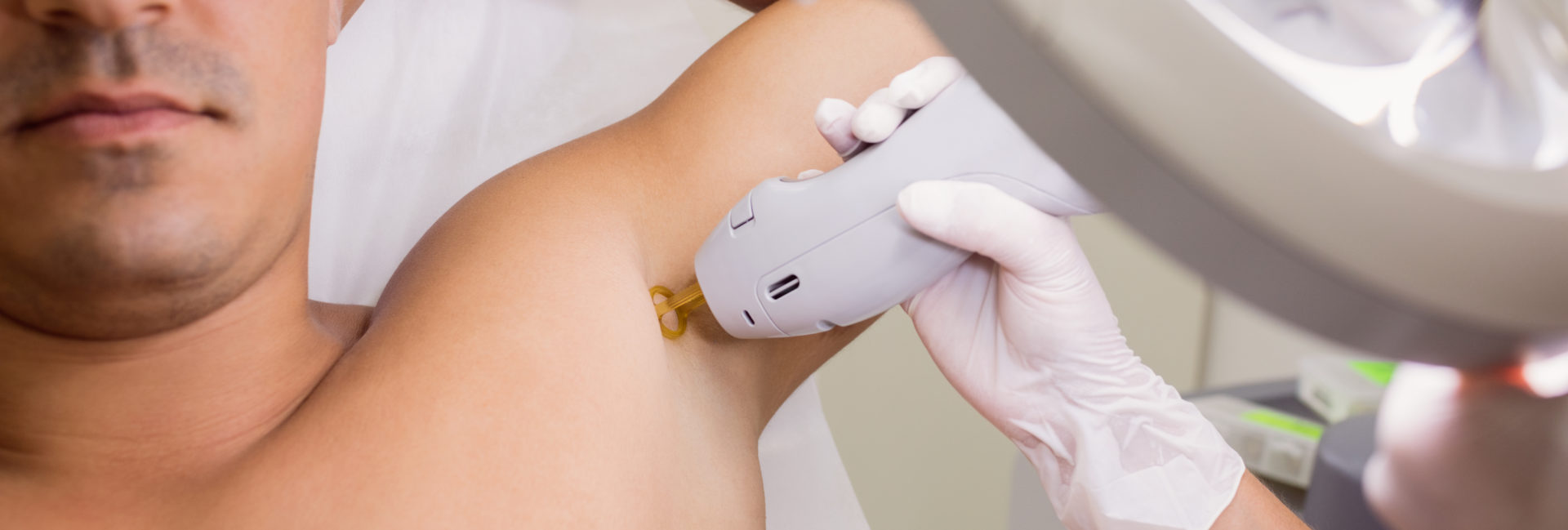
🔹 Épilation laser
L’épilation laser est aujourd’hui la méthode de référence pour réduire durablement la pilosité. En ciblant le pigment du poil, le laser détruit le follicule pileux sans endommager la peau.
Les bénéfices : une peau nette, sans repousse, sans irritation liée au rasage ou à la cire, avec un résultat définitif sur la majorité des poils.
🔹 Traitements laser du visage
Les lasers médicaux offrent une large palette de soins :
- Resurfacing pour améliorer la texture et lisser les ridules.
- Traitement des taches pigmentaires (taches brunes, lentigos).
- Amélioration des cicatrices d’acné ou des cicatrices chirurgicales.
- Laser vasculaire pour corriger les rougeurs et la couperose.
Ces traitements stimulent la régénération cutanée et redonnent éclat et tonicité à la peau, sans chirurgie.
L’avenir : l’intelligence artificielle au service de la médecine et de l’esthétique
L’intelligence artificielle bouleverse déjà la pratique médicale. Capable d’analyser des millions de données, elle permet des diagnostics plus rapides, une détection précoce des maladies et une personnalisation poussée des traitements. En chirurgie esthétique, elle offre la possibilité de simuler le résultat d’une opération avant de l’effectuer, d’optimiser les doses de produits injectables ou encore d’assister le chirurgien par la robotique et la planification numérique. L’IA ne remplace pas le savoir-faire humain, mais elle l’enrichit, offrant des outils de précision et de sécurité supplémentaires pour chaque patient.